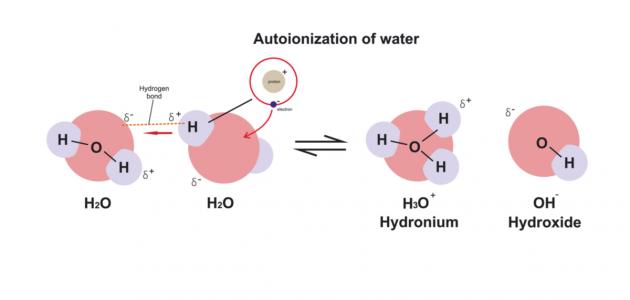
الماء، أساس الحياة، ليس مجرد مركب ثابت، بل هو في حالة تفاعل ديناميكي مستمر. فجزيئات الماء تتفكك تلقائيًا إلى أيونات الهيدرونيوم (H3O+) والهيدروكسيد (OH-)، وهي عملية تعرف باسم التأين الذاتي للماء. هذه العملية بالغة الأهمية في العديد من التفاعلات الكيميائية والبيولوجية، وتلعب دورًا حيويًا في الحفاظ على توازن الأس الهيدروجيني في الأنظمة المائية.
مفهوم تأين الماء
تأين الماء هو تفاعل كيميائي تتفاعل فيه جزيئات الماء مع بعضها البعض، تمامًا كما تتفاعل الأحماض والقواعد. في هذه العملية، تتبادل كمية ضئيلة من جزيئات الماء البروتونات (أيونات الهيدروجين الموجبة) فيما بينها، وهو ما يعرف بالتأين الذاتي للماء. يمكن تمثيل هذه العملية بالمعادلة التالية:
H2O + H2O ⇌ H3O+ + OH-
في هذا التفاعل، تتصرف إحدى جزيئات الماء كحمض (مانحة للبروتون) وفقًا لمفهوم برونستد-لوري، بينما تتصرف الجزيئة الأخرى كقاعدة (مستقبلة للبروتون). ونتيجة لذلك، تتكون أيونات الهيدرونيوم (H3O+) وأيونات الهيدروكسيد (OH-) بنسبة مولية متساوية (1:1). في أي عينة من الماء النقي، يجب أن يتساوى التركيز المولي لأيونات الهيدرونيوم مع التركيز المولي لأيونات الهيدروكسيد.
ملاحظات هامة حول تأين الماء
- الماء مركب مذبذب (amphoteric)؛ أي أنه يمكن أن يتصرف كحمض أو كقاعدة اعتمادًا على الظروف المحيطة. فهو يتصرف كقاعدة عند تفاعله مع الأحماض، ويتصرف كحمض عند تفاعله مع القواعد.
- تأين الماء عملية انعكاسية، مما يعني أن التفاعل يمكن أن يسير في كلا الاتجاهين. وذلك لأن الماء حمض ضعيف وقاعدة ضعيفة أيضًا.
- تركيز أيونات الهيدروكسيد والهيدرونيوم الناتج عن تأين الماء يكون قليلًا جدًا مقارنة بالكمية الكلية للماء غير المتأين.
ثابت تأين الماء (Kw)
يمكن تحديد ثابت تأين الماء (Kw) من خلال تطبيق قانون فعل الكتلة على معادلة تأين الماء:
Kw = [H3O+][OH-]
عند درجة حرارة 25 درجة مئوية، تبلغ قيمة Kw حوالي 1.0 × 10^-14. هذه القيمة الصغيرة تشير إلى أن تأين الماء يحدث بدرجة طفيفة جدًا.
مثال على حساب تركيز أيون الهيدرونيوم
لنفترض أن لدينا محلولًا مائيًا تركيزه 0.001 مولار. لحساب تركيز أيون الهيدرونيوم في هذا المحلول عند درجة حرارة 25 درجة مئوية، نستخدم العلاقة التالية:
[H3O+] = Kw / [OH-]
بما أن [OH-] = 0.001 مولار، فإن:
[H3O+] = (1.0 × 10^-14) / 0.001 = 1.0 × 10^-11 مولار
الخلاصة
تأين الماء عملية حيوية تحدث باستمرار، وتلعب دورًا محوريًا في تحديد الخصائص الكيميائية للماء وتأثيره على التفاعلات المختلفة. فهم هذه العملية يساعدنا في فهم أعمق للكيمياء الحيوية والعمليات البيئية التي تعتمد على الماء.